摘要:本研究開發出能選擇性降低軸突tau水平的反義寡核苷酸(MAPT-ASOs)。
在神經退行性疾病研究領域,阿爾茨海默病(AD)的病理機制一直是科學家們攻堅的重點。這種疾病最顯著的特征是大腦中異常沉積的兩種蛋白質:細胞外形成的淀粉樣蛋白β(Aβ)斑塊,以及神經元內聚集的磷酸化tau蛋白形成的神經原纖維纏結。有趣的是,雖然Aβ斑塊在AD患者腦中廣泛分布,但tau病理的嚴重程度與認知功能障礙的進展更為密切。更關鍵的是,tau的異常聚集往往最早出現在神經元的軸突中,然后才擴散到細胞體,這提示軸突可能是tau病理的起源地。
德國維爾茨堡大學醫院(University Hospital Wuerzburg)的Abdolhossein Zare和Saeede Salehi等研究人員開展了一項突破性研究。他們發現RNA結合蛋白hnRNP R能特異性結合tau編碼基因Mapt mRNA的3'非翻譯區(3'UTR),促進其在軸突中的定位和局部翻譯。通過構建hnRNP R基因敲除小鼠與5xFAD AD模型小鼠雜交,研究人員觀察到這些小鼠大腦中磷酸化tau聚集和Aβ斑塊顯著減少。更令人振奮的是,團隊設計出靶向hnRNP R結合位點的反義寡核苷酸(MAPT-ASOs),在體外培養的小鼠和人類神經元中成功實現了軸突特異性tau降低,而細胞體中的tau水平保持不變。當通過腦室注射將MAPT-ASO2遞送至5xFAD小鼠大腦后,不僅減少了tau病理,還改善了淀粉樣蛋白沉積和神經元丟失。這項研究發表在《Translational Neurodegeneration》上,為AD治療提供了新思路。

圖1 減少軸突Tau蛋白可緩解阿爾茨海默病小鼠模型中的Tau蛋白和淀粉樣蛋白病理
研究采用了多項關鍵技術:通過微流控室培養實現神經元軸突與胞體區室分離;利用RNA免疫共沉淀驗證hnRNP R與Mapt mRNA的相互作用;采用ViewRNA熒光原位雜交(FISH)和嘌呤霉素標記-鄰近連接實驗(Puro-PLA)分別檢測軸突Mapt mRNA定位和局部tau翻譯;設計2'-O-甲基修飾的全硫代磷酸反義寡核苷酸(MAPT-ASOs)阻斷hnRNP R結合;對5xFAD小鼠進行腦室注射給藥后,通過質譜分析全腦蛋白質組變化。
研究結果部分:
hnRNP R調控軸突tau水平
通過iCLIP技術發現hnRNP R結合Mapt mRNA的3'UTR區域。在hnRNP R敲除小鼠的原代運動神經元中,軸突而非胞體的Mapt mRNA和tau蛋白水平顯著降低。
hnRNP R缺失減輕AD病理
5xFAD/hnRNP R-/-小鼠的海馬和皮層中,磷酸化tau(AT180+/AT8+)和Thioflavin S陽性結構減少40-60%,Aβ斑塊和活化小膠質細胞(Iba1+)數量也顯著下降,筑巢行為得到改善。
MAPT-ASOs實現軸突特異性tau降低
設計的MAPT-ASO2能特異性減少軸突Mapt mRNA和tau蛋白,而不影響胞體tau水平或微管蛋白分布。在人類iPSC衍生運動神經元中也驗證了該效果。
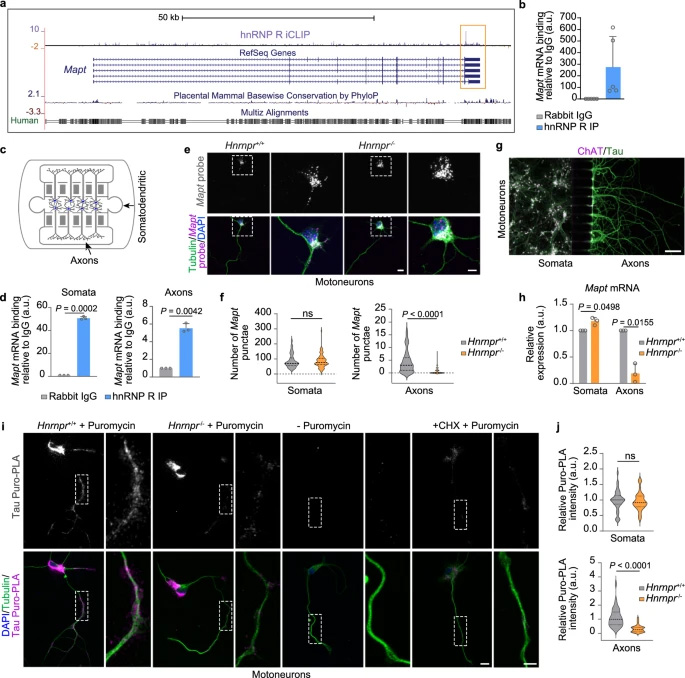
圖2 hnRNP R 調控軸突內 Mapt 水平及局部 tau 蛋白合成
MAPT-ASO2治療改善AD表型
腦室注射MAPT-ASO2的5xFAD小鼠顯示:海馬體積增加15%,CA1區NeuN+神經元數量增多;皮層和海馬中總tau和磷酸化tau(AT8/AT180)減少30-50%;Aβ斑塊負荷降低40%;蛋白質組分析發現RNA結合蛋白Ybx1等tau相互作用蛋白水平回升。
這項研究的重要意義在于首次證明選擇性降低軸突tau足以改善AD相關的tau和淀粉樣蛋白病理。與目前臨床開發的全局性tau降低策略相比,這種靶向軸突的干預方式更能保留tau在神經元胞體中的生理功能,如DNA損傷保護等。研究發現hnRNP R-Mapt mRNA相互作用的關鍵調控區域,為開發更精準的ASO療法奠定了基礎。此外,研究揭示的軸突tau與Aβ病理間的相互作用機制,也為理解AD發病機制提供了新視角。這些發現不僅對AD治療具有重要價值,也為其他tau蛋白病如額顳葉癡呆等的治療策略開發提供了參考。
參考資料
[1] Axonal tau reduction ameliorates tau and amyloid pathology in a mouse model of Alzheimer’s disease
摘要:本研究開發出能選擇性降低軸突tau水平的反義寡核苷酸(MAPT-ASOs)。
在神經退行性疾病研究領域,阿爾茨海默病(AD)的病理機制一直是科學家們攻堅的重點。這種疾病最顯著的特征是大腦中異常沉積的兩種蛋白質:細胞外形成的淀粉樣蛋白β(Aβ)斑塊,以及神經元內聚集的磷酸化tau蛋白形成的神經原纖維纏結。有趣的是,雖然Aβ斑塊在AD患者腦中廣泛分布,但tau病理的嚴重程度與認知功能障礙的進展更為密切。更關鍵的是,tau的異常聚集往往最早出現在神經元的軸突中,然后才擴散到細胞體,這提示軸突可能是tau病理的起源地。
德國維爾茨堡大學醫院(University Hospital Wuerzburg)的Abdolhossein Zare和Saeede Salehi等研究人員開展了一項突破性研究。他們發現RNA結合蛋白hnRNP R能特異性結合tau編碼基因Mapt mRNA的3'非翻譯區(3'UTR),促進其在軸突中的定位和局部翻譯。通過構建hnRNP R基因敲除小鼠與5xFAD AD模型小鼠雜交,研究人員觀察到這些小鼠大腦中磷酸化tau聚集和Aβ斑塊顯著減少。更令人振奮的是,團隊設計出靶向hnRNP R結合位點的反義寡核苷酸(MAPT-ASOs),在體外培養的小鼠和人類神經元中成功實現了軸突特異性tau降低,而細胞體中的tau水平保持不變。當通過腦室注射將MAPT-ASO2遞送至5xFAD小鼠大腦后,不僅減少了tau病理,還改善了淀粉樣蛋白沉積和神經元丟失。這項研究發表在《Translational Neurodegeneration》上,為AD治療提供了新思路。

圖1 減少軸突Tau蛋白可緩解阿爾茨海默病小鼠模型中的Tau蛋白和淀粉樣蛋白病理
研究采用了多項關鍵技術:通過微流控室培養實現神經元軸突與胞體區室分離;利用RNA免疫共沉淀驗證hnRNP R與Mapt mRNA的相互作用;采用ViewRNA熒光原位雜交(FISH)和嘌呤霉素標記-鄰近連接實驗(Puro-PLA)分別檢測軸突Mapt mRNA定位和局部tau翻譯;設計2'-O-甲基修飾的全硫代磷酸反義寡核苷酸(MAPT-ASOs)阻斷hnRNP R結合;對5xFAD小鼠進行腦室注射給藥后,通過質譜分析全腦蛋白質組變化。
研究結果部分:
hnRNP R調控軸突tau水平
通過iCLIP技術發現hnRNP R結合Mapt mRNA的3'UTR區域。在hnRNP R敲除小鼠的原代運動神經元中,軸突而非胞體的Mapt mRNA和tau蛋白水平顯著降低。
hnRNP R缺失減輕AD病理
5xFAD/hnRNP R-/-小鼠的海馬和皮層中,磷酸化tau(AT180+/AT8+)和Thioflavin S陽性結構減少40-60%,Aβ斑塊和活化小膠質細胞(Iba1+)數量也顯著下降,筑巢行為得到改善。
MAPT-ASOs實現軸突特異性tau降低
設計的MAPT-ASO2能特異性減少軸突Mapt mRNA和tau蛋白,而不影響胞體tau水平或微管蛋白分布。在人類iPSC衍生運動神經元中也驗證了該效果。

圖2 hnRNP R 調控軸突內 Mapt 水平及局部 tau 蛋白合成
MAPT-ASO2治療改善AD表型
腦室注射MAPT-ASO2的5xFAD小鼠顯示:海馬體積增加15%,CA1區NeuN+神經元數量增多;皮層和海馬中總tau和磷酸化tau(AT8/AT180)減少30-50%;Aβ斑塊負荷降低40%;蛋白質組分析發現RNA結合蛋白Ybx1等tau相互作用蛋白水平回升。
這項研究的重要意義在于首次證明選擇性降低軸突tau足以改善AD相關的tau和淀粉樣蛋白病理。與目前臨床開發的全局性tau降低策略相比,這種靶向軸突的干預方式更能保留tau在神經元胞體中的生理功能,如DNA損傷保護等。研究發現hnRNP R-Mapt mRNA相互作用的關鍵調控區域,為開發更精準的ASO療法奠定了基礎。此外,研究揭示的軸突tau與Aβ病理間的相互作用機制,也為理解AD發病機制提供了新視角。這些發現不僅對AD治療具有重要價值,也為其他tau蛋白病如額顳葉癡呆等的治療策略開發提供了參考。
參考資料
[1] Axonal tau reduction ameliorates tau and amyloid pathology in a mouse model of Alzheimer’s disease



