癌癥,一直是當(dāng)今社會(huì)面臨的嚴(yán)峻的問(wèn)題之一,自從2018年癌癥的免疫療法獲得諾貝爾獎(jiǎng)以來(lái),有關(guān)人體自身免疫對(duì)抗癌癥的臨床研究越來(lái)越多,但是收效并沒(méi)有達(dá)到預(yù)期。造成這一問(wèn)題的主要原因是免疫系統(tǒng)的作用機(jī)制還沒(méi)有全部搞清楚,進(jìn)而限制了免疫療法的應(yīng)用和發(fā)展。因此,研究并闡明癌細(xì)胞如何逃避免疫系統(tǒng)的“追殺”是尋找下一代癌癥免疫療法的關(guān)鍵一步。
近期,來(lái)自哈佛醫(yī)學(xué)院的研究團(tuán)隊(duì),在《Nature nanotechnology》發(fā)表了題為“Intercellularnanotubes mediate mitochondrial trafficking between cancer and immune cells”的文章,表述了癌細(xì)胞可以通過(guò)微/納米管從免疫細(xì)胞中“偷走”線粒體并證明了納米管介導(dǎo)的線粒體從免疫細(xì)胞向癌細(xì)胞的轉(zhuǎn)移增強(qiáng)了癌細(xì)胞的代謝,提高了癌細(xì)胞侵襲性。

為了觀察到癌細(xì)胞和免疫細(xì)胞之間的微管,研究者們將不同的小鼠和人類(lèi)乳腺癌細(xì)胞與效應(yīng)免疫細(xì)胞(NKT、CD3+/CD8+ )共培養(yǎng),并使用場(chǎng)發(fā)射掃描電子顯微鏡(FESEM)檢測(cè)共培養(yǎng)過(guò)程中的細(xì)胞間相互作用。結(jié)果顯示,癌細(xì)胞和免疫細(xì)胞通過(guò)納米管狀結(jié)構(gòu)物理連接,在某些情況下,來(lái)自癌細(xì)胞的單個(gè)納米管與多個(gè)免疫細(xì)胞串聯(lián),并與免疫細(xì)胞膜形成多個(gè)接觸。
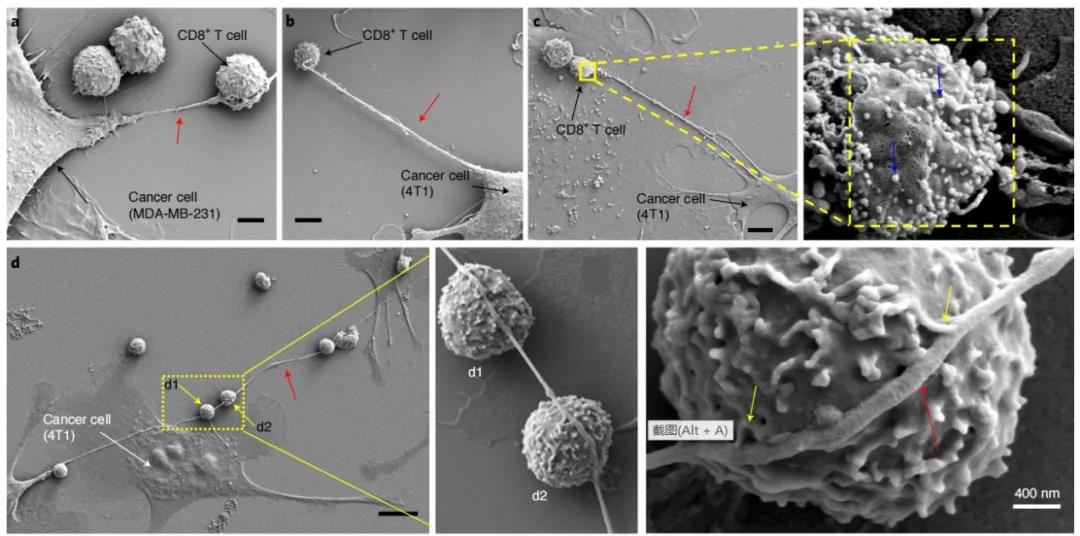
在以往的研究中發(fā)現(xiàn),這種微管/納米管結(jié)構(gòu)在調(diào)節(jié)細(xì)胞間通信、T細(xì)胞之間的艾滋病毒轉(zhuǎn)移、神經(jīng)元之間的朊病毒轉(zhuǎn)移等方面都有作用。納米管還可以在細(xì)胞間交易細(xì)胞器,比如線粒體的轉(zhuǎn)移。線粒體功能對(duì)于免疫細(xì)胞的擴(kuò)增、細(xì)胞因子的產(chǎn)生和有效的記憶反應(yīng)至關(guān)重要,主要是因?yàn)榫€粒體中的ATP氧化磷酸化過(guò)程中提供的能量。對(duì)于癌細(xì)胞,線粒體可以提升癌細(xì)胞的能量供給,增加癌細(xì)胞擴(kuò)增效率并提高化療耐藥性。
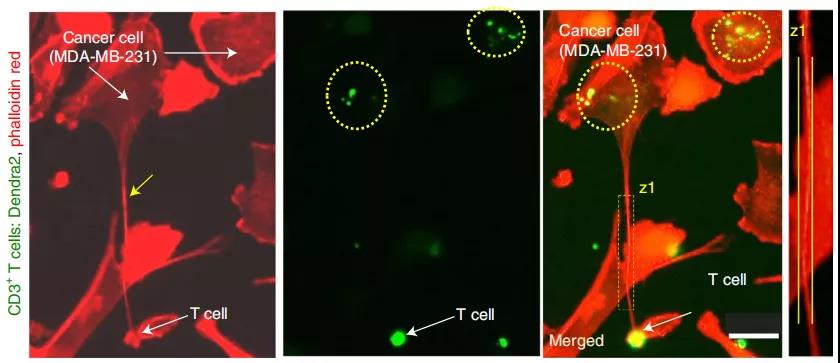
在本研究中,研究者們熒光標(biāo)記了免疫細(xì)胞細(xì)胞中的線粒體,加入到未標(biāo)記過(guò)的乳腺癌細(xì)胞中共培養(yǎng)16小時(shí),發(fā)現(xiàn)乳腺癌細(xì)胞中觀察到大量的斑點(diǎn)熒光,說(shuō)明了線粒體從免疫細(xì)胞轉(zhuǎn)移到癌細(xì)胞。再利用phalloidin紅(一種染色劑)標(biāo)記培養(yǎng)液中的納米管,我們觀察到熒光標(biāo)記的線粒體在納米管內(nèi)的共定位,說(shuō)明線粒體是通過(guò)納米管傳輸?shù)摹?/div>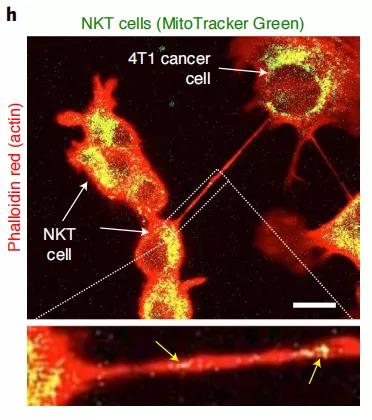
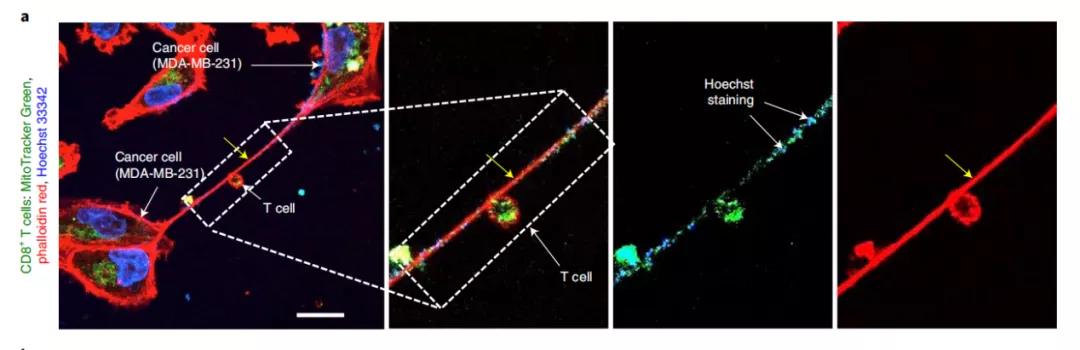

此外,研究者們用Hoechst染料標(biāo)記DNA(細(xì)胞核和線粒體),觀察到線粒體和DNA在納米管中共定位,進(jìn)一步驗(yàn)證了納米管的線粒體運(yùn)輸,并且線粒體是完整無(wú)損的,并且研究者們也在小鼠模型中也發(fā)現(xiàn)了類(lèi)似現(xiàn)象。


為了量化免疫細(xì)胞和癌細(xì)胞之間的線粒體轉(zhuǎn)移,研究者們先用CellTrace Far Red (一種紅色標(biāo)記物)標(biāo)記癌細(xì)胞,然后與標(biāo)記線粒體(綠色)的T細(xì)胞共培養(yǎng),然后使用流式細(xì)胞術(shù)量化示蹤劑在細(xì)胞之間的轉(zhuǎn)移。作為對(duì)照,研究者們?cè)趯?duì)照組設(shè)置了一層400納米孔的膜隔開(kāi)癌細(xì)胞和免疫細(xì)胞,可以允許分泌的信號(hào)分子和外泌體通過(guò),但阻止通過(guò)物理納米管的直接細(xì)胞通信。剛開(kāi)始時(shí),免疫細(xì)胞和癌細(xì)胞相對(duì)獨(dú)立的存在兩個(gè)區(qū)域,然而,培養(yǎng)16小時(shí)后,一個(gè)新的混合區(qū)域就產(chǎn)生了。在對(duì)照組(加膜組)沒(méi)有這種現(xiàn)象,這就說(shuō)明這種線粒體轉(zhuǎn)移現(xiàn)象是通過(guò)微管進(jìn)行的直接的物理對(duì)接而不是信號(hào)分子或者外泌體傳遞的信息。此外,研究者們還對(duì)不同的免疫細(xì)胞進(jìn)行了相同的實(shí)驗(yàn),發(fā)現(xiàn)它們都有相同的實(shí)驗(yàn)結(jié)果,說(shuō)明線粒體通過(guò)微管在免疫細(xì)胞和癌細(xì)胞之間傳遞的現(xiàn)象是普遍存在的。
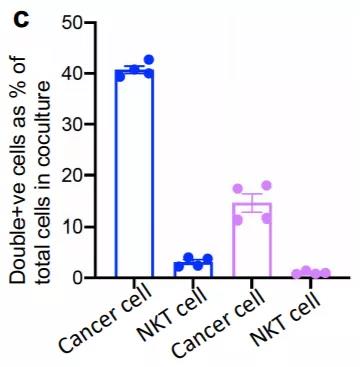
研究者們又測(cè)試了線粒體轉(zhuǎn)移的指向性。實(shí)驗(yàn)表明,接收免疫細(xì)胞標(biāo)記線粒體的癌細(xì)胞占總細(xì)胞的41.00%,而在反向培養(yǎng)中接收癌細(xì)胞標(biāo)記線粒體的免疫細(xì)胞在共培養(yǎng)中只占總細(xì)胞的0.99%。因此,研究者們得出了結(jié)論:線粒體從免疫細(xì)胞向癌細(xì)胞的運(yùn)輸是單向的。

接下來(lái),研究者們研究了線粒體轉(zhuǎn)移對(duì)癌細(xì)胞代謝的影響。從共培養(yǎng)中分離出來(lái)的癌細(xì)胞比用膜隔開(kāi)與免疫細(xì)胞共培養(yǎng)和單一培養(yǎng)的對(duì)照組癌細(xì)胞表現(xiàn)出更高代謝能力。
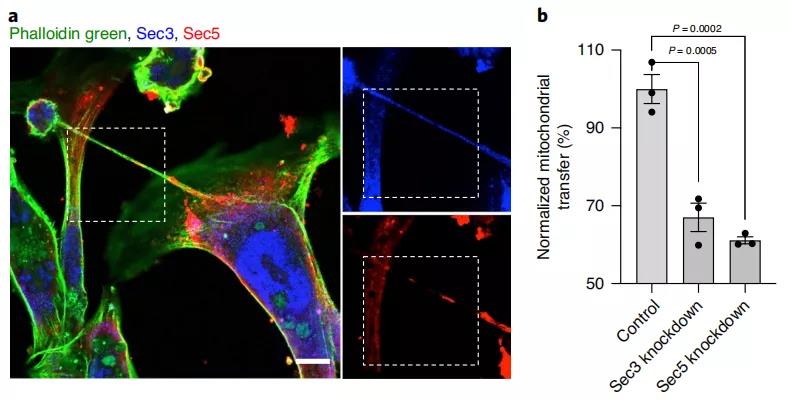
為了驗(yàn)證癌細(xì)胞的代謝增強(qiáng)是否由于從免疫細(xì)胞獲得線粒體,在與癌細(xì)胞共培養(yǎng)前,使用抗霉素A和魚(yú)藤酮或溴化乙啶破壞免疫細(xì)胞的線粒體,證實(shí)了癌細(xì)胞中的代謝增強(qiáng)是由于從免疫細(xì)胞中獲得了線粒體。后面,研究者們又發(fā)現(xiàn)納米管的形成與囊外復(fù)合物(sec3/sec5)密切相關(guān),囊外復(fù)合物可以誘導(dǎo)細(xì)胞之間肌動(dòng)蛋白重塑,進(jìn)而形成微管。如果把Sec3或Sec5相關(guān)的基因敲除就可以大大減少免疫細(xì)胞和癌細(xì)胞之間的線粒體運(yùn)輸。

本次研究得出結(jié)論,納米管介導(dǎo)的線粒體傳輸可能成為一種新的癌細(xì)胞逃避免疫的機(jī)制。雖然目前已批準(zhǔn)的免疫治療藥物可以通過(guò)刺激免疫系統(tǒng)來(lái)激活免疫細(xì)胞,但如果免疫細(xì)胞的線粒體“被偷”,代謝受阻,一切都是白費(fèi)了。因此,本研究的內(nèi)容可以進(jìn)一步啟發(fā)新的免疫療法。但是還有許多問(wèn)題需要解決,比如,是什么驅(qū)動(dòng)這些納米管向特定細(xì)胞形成?是什么導(dǎo)致線粒體優(yōu)先從免疫細(xì)胞向癌細(xì)胞移動(dòng)?總的來(lái)說(shuō),免疫療法是一個(gè)新興的治療手段,雖然已經(jīng)有些臨床成效,已經(jīng)能夠看到勝利的曙光,然而相關(guān)的機(jī)理探究還是任重而道遠(yuǎn)。不是我們不努力,實(shí)在是敵人太狡猾,不講武德搞偷襲啊!



