摘要:一項(xiàng)研究發(fā)現(xiàn),抗精神病藥物阿塞那平(asenapine)可能通過TAAR1受體起作用,從而揭示了人類和嚙齒動(dòng)物TAAR1之間的關(guān)鍵差異。
西奈山伊坎大學(xué)的科學(xué)家們用CryoEM拍攝了藥物如何與TAAR1受體結(jié)合的詳細(xì)照片。他們還發(fā)現(xiàn),抗精神病藥物阿塞那平出人意料地激活了TAAR1,這可能有助于阿塞那平的治療效果。研究揭示了TAAR1,指出了藥物開發(fā)中潛在的增強(qiáng)機(jī)會(huì)。
西奈山伊坎醫(yī)學(xué)院的研究人員發(fā)現(xiàn)了抗精神病藥物阿塞那平的潛在作用機(jī)制,阿塞那平可能是藥物使用和神經(jīng)精神疾病的治療靶點(diǎn)。這一發(fā)現(xiàn)可能為開發(fā)針對(duì)相同途徑的改進(jìn)藥物鋪平道路。
他們的研究結(jié)果詳細(xì)發(fā)表在1月2日的《自然通訊》(Nature Communications)網(wǎng)絡(luò)版上。研究表明,一種被稱為TAAR1受體的腦蛋白(一種已知調(diào)節(jié)大腦關(guān)鍵獎(jiǎng)賞通路中多巴胺信號(hào)的藥物靶點(diǎn))與臨床前嚙齒類動(dòng)物模型(通常用于藥物測試)相比,在人類身上存在顯著差異。

圖1 人類微量胺相關(guān)受體1激活的分子基礎(chǔ)
該研究建議考慮藥物受體相互作用的物種特異性差異,并進(jìn)一步研究阿塞那平影響身體的方式,作為潛在治療改進(jìn)的步驟。
“在研究TAAR1的功能和結(jié)構(gòu)特性時(shí),我們的研究旨在更多地闡明其機(jī)制和藥理學(xué),”該研究的第一作者、伊坎西奈山的博士候選人 Gregory Zilberg說。“我們的發(fā)現(xiàn)可能會(huì)指導(dǎo)新型TAAR1藥物的開發(fā),并促使更多類似阿塞那平的藥物的探索。”
利用先進(jìn)的技術(shù)研究TAAR1的結(jié)構(gòu)和功能,研究人員確定了三個(gè)重要的元素。首先,嚙齒動(dòng)物和人類TAAR1之間存在差異,這可能會(huì)影響臨床前模型研究如何轉(zhuǎn)化為人類。其次,TAAR1與血清素和多巴胺受體的關(guān)系比之前認(rèn)為的要密切得多。這表明,幾種以血清素為靶點(diǎn)的藥物可能具有未知的治療效果或副作用,實(shí)際上是由于它們?cè)赥AAR1上的作用。
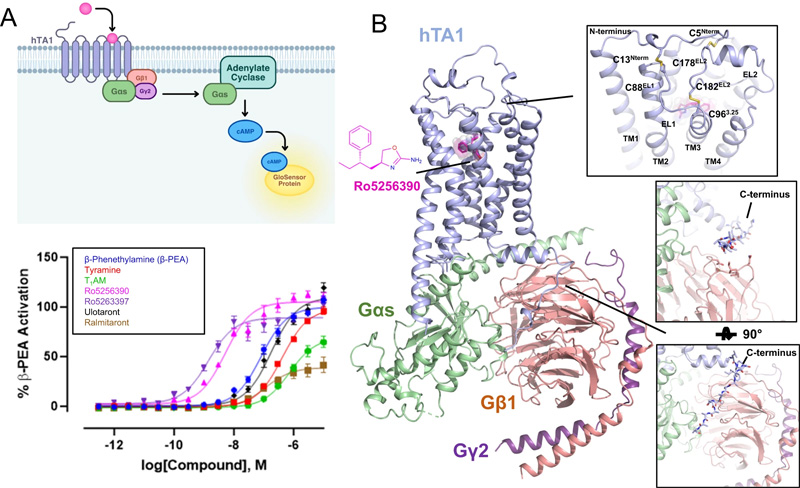
圖2 hTA1-Gs復(fù)合物的藥理學(xué)和結(jié)構(gòu)特征
最后,研究人員強(qiáng)調(diào),臨床使用的抗精神病藥物阿塞那平意外地顯示出TAAR1的強(qiáng)烈激活,這表明事實(shí)上,這種靶向5 -羥色胺和多巴胺的抗精神病藥物可能從TAAR1的激活中獲得一些治療效果。如果在進(jìn)一步的研究中得到證實(shí),這可能為其在其他與taar1相關(guān)的治療應(yīng)用中的潛力開辟新的可能性,例如在物質(zhì)使用障礙中的使用,以及開發(fā)新的基于阿塞那平的藥物。
研究人員指出,缺乏關(guān)于TAAR1在嚙齒動(dòng)物和人類中如何起作用的差異的信息,并強(qiáng)調(diào)這些差異中的一些可以解釋為什么TAAR1的臨床前數(shù)據(jù)尚未成功轉(zhuǎn)化為有效的人類治療方法。接下來,研究人員計(jì)劃研究TAAR1在細(xì)胞中的位置,以及它在影響血清素和多巴胺信號(hào)傳導(dǎo)中的確切作用。
“這項(xiàng)研究為理解TAAR1提供了重大飛躍,為藥物開發(fā)提供了潛在途徑,并鼓勵(lì)進(jìn)一步研究其治療應(yīng)用,”伊坎西奈山藥理學(xué)和神經(jīng)科學(xué)助理教授Daniel Wacker博士說。“隨著我們工作的進(jìn)展,我們預(yù)計(jì)它可能在形成針對(duì)TAAR1的新藥開發(fā)中發(fā)揮關(guān)鍵作用,并為類似阿塞那平的藥物如何起作用提供有價(jià)值的見解。”
參考資料
[1] “Molecular basis of human trace amine-associated receptor 1 activation” by Gregory Zilberg, Alexandra K. Parpounas, Audrey L. Warren, Shifan Yang and Daniel Wacker, 2 January 2024, Nature Communications.
摘要:一項(xiàng)研究發(fā)現(xiàn),抗精神病藥物阿塞那平(asenapine)可能通過TAAR1受體起作用,從而揭示了人類和嚙齒動(dòng)物TAAR1之間的關(guān)鍵差異。
西奈山伊坎大學(xué)的科學(xué)家們用CryoEM拍攝了藥物如何與TAAR1受體結(jié)合的詳細(xì)照片。他們還發(fā)現(xiàn),抗精神病藥物阿塞那平出人意料地激活了TAAR1,這可能有助于阿塞那平的治療效果。研究揭示了TAAR1,指出了藥物開發(fā)中潛在的增強(qiáng)機(jī)會(huì)。
西奈山伊坎醫(yī)學(xué)院的研究人員發(fā)現(xiàn)了抗精神病藥物阿塞那平的潛在作用機(jī)制,阿塞那平可能是藥物使用和神經(jīng)精神疾病的治療靶點(diǎn)。這一發(fā)現(xiàn)可能為開發(fā)針對(duì)相同途徑的改進(jìn)藥物鋪平道路。
他們的研究結(jié)果詳細(xì)發(fā)表在1月2日的《自然通訊》(Nature Communications)網(wǎng)絡(luò)版上。研究表明,一種被稱為TAAR1受體的腦蛋白(一種已知調(diào)節(jié)大腦關(guān)鍵獎(jiǎng)賞通路中多巴胺信號(hào)的藥物靶點(diǎn))與臨床前嚙齒類動(dòng)物模型(通常用于藥物測試)相比,在人類身上存在顯著差異。

圖1 人類微量胺相關(guān)受體1激活的分子基礎(chǔ)
該研究建議考慮藥物受體相互作用的物種特異性差異,并進(jìn)一步研究阿塞那平影響身體的方式,作為潛在治療改進(jìn)的步驟。
“在研究TAAR1的功能和結(jié)構(gòu)特性時(shí),我們的研究旨在更多地闡明其機(jī)制和藥理學(xué),”該研究的第一作者、伊坎西奈山的博士候選人 Gregory Zilberg說。“我們的發(fā)現(xiàn)可能會(huì)指導(dǎo)新型TAAR1藥物的開發(fā),并促使更多類似阿塞那平的藥物的探索。”
利用先進(jìn)的技術(shù)研究TAAR1的結(jié)構(gòu)和功能,研究人員確定了三個(gè)重要的元素。首先,嚙齒動(dòng)物和人類TAAR1之間存在差異,這可能會(huì)影響臨床前模型研究如何轉(zhuǎn)化為人類。其次,TAAR1與血清素和多巴胺受體的關(guān)系比之前認(rèn)為的要密切得多。這表明,幾種以血清素為靶點(diǎn)的藥物可能具有未知的治療效果或副作用,實(shí)際上是由于它們?cè)赥AAR1上的作用。

圖2 hTA1-Gs復(fù)合物的藥理學(xué)和結(jié)構(gòu)特征
最后,研究人員強(qiáng)調(diào),臨床使用的抗精神病藥物阿塞那平意外地顯示出TAAR1的強(qiáng)烈激活,這表明事實(shí)上,這種靶向5 -羥色胺和多巴胺的抗精神病藥物可能從TAAR1的激活中獲得一些治療效果。如果在進(jìn)一步的研究中得到證實(shí),這可能為其在其他與taar1相關(guān)的治療應(yīng)用中的潛力開辟新的可能性,例如在物質(zhì)使用障礙中的使用,以及開發(fā)新的基于阿塞那平的藥物。
研究人員指出,缺乏關(guān)于TAAR1在嚙齒動(dòng)物和人類中如何起作用的差異的信息,并強(qiáng)調(diào)這些差異中的一些可以解釋為什么TAAR1的臨床前數(shù)據(jù)尚未成功轉(zhuǎn)化為有效的人類治療方法。接下來,研究人員計(jì)劃研究TAAR1在細(xì)胞中的位置,以及它在影響血清素和多巴胺信號(hào)傳導(dǎo)中的確切作用。
“這項(xiàng)研究為理解TAAR1提供了重大飛躍,為藥物開發(fā)提供了潛在途徑,并鼓勵(lì)進(jìn)一步研究其治療應(yīng)用,”伊坎西奈山藥理學(xué)和神經(jīng)科學(xué)助理教授Daniel Wacker博士說。“隨著我們工作的進(jìn)展,我們預(yù)計(jì)它可能在形成針對(duì)TAAR1的新藥開發(fā)中發(fā)揮關(guān)鍵作用,并為類似阿塞那平的藥物如何起作用提供有價(jià)值的見解。”
參考資料
[1] “Molecular basis of human trace amine-associated receptor 1 activation” by Gregory Zilberg, Alexandra K. Parpounas, Audrey L. Warren, Shifan Yang and Daniel Wacker, 2 January 2024, Nature Communications.



